理化学研究所 生命機能科学研究センター(2018年4月より)
分子標的化学研究チーム
RIKEN Center for Biosystems Dynamics Research (BDR)
Laboratory for Chemical Biology
Publication
40. “Palladium-Catalyzed ipso-Borylation of Aryl Halides Promoted by Lewis Acid-Mediated Electrophilic Activation of Aryl(halo)palladium(II) Complex”
Takashi Niwa*, Tadashi Takimoto, Yuki Sakata, Takamitsu Hosoya*
Org. Lett. 2023, 25, 8173–8177 DOI: 10.1021/acs.orglett.3c03531

39. “Synthesis of Multisubstituted Aromatics via 3-Triazenylarynes”
Jumpei Taguchi, Takumi Okuyama, Satomi Tomita, Takashi Niwa, Takamitsu Hosoya*
Org. Lett. 2023, 25, 7030–7034 DOI: 10.1021/acs.orglett.3c02615

38. “11C-Cyanation of Aryl Fluorides via Nickel and Lithium Chloride-Mediated C–F Bond Activation”
Zhouen Zhang*, Takashi Niwa, Kenji Watanabe, Takamitsu Hosoya*
Angew. Chem. Int. Ed. 2023, 62, e202302956 DOI: 10.1002/anie.202302956

37. “Synthesis of 11C-Radiolabeled Eribulin as a Companion Diagnostics PET Tracer for Brain Glioblastoma”
Takashi Niwa, Tsuyoshi Tahara, Charles E. Chase, Francis G. Fang, Takayoshi Nakaoka, Satsuki Irie, Emi Hayashinaka, Yasuhiro Wada, Hidefumi Mukai, Kenkichi Masutomi, Yasuyoshi Watanabe, Yilong Cui, Takamitsu Hosoya*
Bull. Chem. Soc. Jpn. 2023, 96, 283–290, DOI: 10.1246/bcsj.20220335.

36. “Acute nicotine exposure blocks aromatase in the limbic brain of healthy women: A [11C]cetrozole PET study”
Manon Dubol, Jana Immenschuh, My Jonasson, Kayo Takahashi, Takashi Niwa, Takamitsu Hosoya, Sara Roslin, Johan Wikström, Gunnar Antoni, Yasuyoshi Watanabe, Mark Lubberink, Anat Biegon, Inger Sundström-Promaa, Erika Comasco*
Compr. Psychiatry 2023, 123, 152381, DOI: 10.1016/j.comppsych.2023.152381.
35. “Red light-induced conjugation of amines through amide bond formation triggered via photooxidation of 3-acylindolizines”
Kenji Watanabe*, Asuka Kuratsu, Daisuke Hashizume, Takashi Niwa, Takamitsu Hosoya
エネルギーの低い長波長光の照射により、望ましくない光分解を回避しつつ、迅速に分子を連結する手法に注目が集まっています。今回私たちは、赤色光の照射を用いた、アミンと3-アシルインドリジンとのアミド結合形成反応を開発しました。本反応では、触媒量の光増感剤と脂肪族アミンの存在下、3-アシルインドリジンに赤色LED(660 nm)を照射することで、5分以内にほぼ定量的に対応するアミドが得られます。本反応は水系溶媒中で実施することもでき、短波長光により分解するジアジニル基を持つアミンを含め、様々な機能性アミンに適用が可能です。

34. “Azido-Type-Selective Triazole Formation by Iridium-Catalyzed Cycloaddition with Thioalkyne”
Kazuya Sugiyama, Yuki Sakata, Takashi Niwa, Suguru Yoshida, Takamitsu Hosoya*
33. “Computational study for amino acid production from carboxylic acid via 14C β-decay”
Tomonori Fukuchi*, Takashi Niwa, Takamitsu Hosoya, Yasuyoshi Watanabe
J. Phys. Soc. Jpn. 2022, 91, 064301, DOI: 10.7566/JPSJ.91.064301, 理研プレスリリース
32. “Expression and purification of DYRK1A kinase domain in complex with its folding intermediate-selective inhibitor FINDY”
Ninako Kimura, Kanako Saito, Takashi Niwa, Masato Yamakawa, Shota Igaue, Junko Ohkanda, Takamitsu Hosoya, Isao Kii*
Protein Expr. Purif. 2022, 195–196, 106089, DOI: 10.1016/j.pep.2022.106089
31. “Clinical evaluation of [18F]pitavastatin for quantitative analysis of hepatobiliary transporter activity”
Takayoshi Nakaoka, Ken-ichi Kaneko, Satsuki Irie, Aya Mawatari, Ami Igesaka, Yuta Uetake, Hidenori Ochiai, Takashi Niwa, Emi Yamano, Yasuhiro Wada, Masaaki Tanaka, Kohei Kotani, Hideki Kawahata, Joji Kawabe, Yukio Miki, Hisashi Doi, Takamitsu Hosoya, Kazuya Maeda, Hiroyuki Kusuhara, Yuichi Sugiyama, Yasuyoshi Watanabe*
Drug Metab. Pharmacokinet. 2022, 44, 100449, DOI: 10.1016/j.dmpk.2022.100449
30. “Structure-activity relationship for the folding intermediate-selective inhibition of DYRK1A”
Yuka Miyazaki, Masaki Kikuchi, Koji Umezawa, Aurelie Descamps, Daichi Nakamura, Gaku Furuie, Tomoe Sumida, Kanako Saito, Ninako Kimura, Takashi Niwa, Yuto Sumida, Takashi Umehara, Takamitsu Hosoya, Isao Kii*
Eur. J. Med. Chem. 2022, 227, 113948, DOI: 10.1016/j.ejmech.2021.113948
29. “Lewis acid-mediated Suzuki–Miyaura Cross-Coupling Reaction”
Takashi Niwa*, Yuta Uetake*, Motoyuki Isoda, Tadashi Takimoto, Miki Nakaoka, Daisuke Hashizume, Hidehiro Sakurai, Takamitsu Hosoya
Nat. Catal. 2021, 4, 1080, DOI: 10.1038/s41929-021-00719-6
OPEN ACCESS, Cover Image of Volume 4, Issue 12, Dec 2021, プレスリリース(理研, 阪大, 東京医科歯科大, SPring-8)
関連する植竹博士のブログ(Nature Portfolio Chemistry Community)


鈴木・宮浦クロスカップリング反応は炭素–炭素結合の形成に信頼性の高い手法の一つです。一般にこの反応には、有機ホウ素化合物の求核性を向上させるために塩基の添加が必要ですが、これによる脱ホウ素プロトン化反応などの副反応の併発が広く課題として知られています。今回我々は、塩基の代わりにルイス酸として亜鉛錯体を添加することによっても本反応が進行することを明らかにしました。このメカニズムを理解するために、大阪大学 植竹裕太 博士(以前当チームの特別研究員でした)との共同研究を通じ、SPring-8での放射光XAFS測定や、錯体反応、計算化学等を用いた反応機構解析を実施しました。その結果、反応中にまず熱的に安定な二核錯体が生じ、ここから金属交換に対する高い活性を有するカチオン性有機パラジウム錯体が徐々に発生する機構が示唆されました。この反応条件は塩基を用いる鈴木・宮浦クロスカップリング反応に比べ遜色ない適用範囲を示し、生物活性化合物の合成などにも応用できます。今回見いだしたカチオン性有機金属錯体の発生手法は、今後新反応の開発へと応用されることが期待されます。
28. “PET imaging of brain aromatase in humans and rhesus monkeys by 11C-labeled cetrozole analogs”
Kayo Takahashi, Takamitsu Hosoya*, Kayo Onoe, Tomoko Mori, Shusaku Tazawa, Aya Mawatari, Yasuhiro Wada, Yumiko Watanabe, Hisashi Doi, Yasuyoshi Watanabe*

27. “Direct 3-Acylation of Indolizines by Carboxylic Acids for the Practical Synthesis of Red Light-Releasable Caged Carboxylic Acids”
Kenji Watanabe,* Nodoka Terao, Takashi Niwa, Takamitsu Hosoya*
私たちは最近、生体透過性の高い赤色光の照射によって3-アシルインドリジンからカルボン酸が放出される事を報告しました。今回、本反応の有用性を高めるために、広く使用されている縮合試薬を用いてカルボン酸から3-アシルインドリジンを合成する方法を開発しました。目的のアシル化反応が温和な条件で進行し、多様な生物活性カルボン酸から3-アシルインドリジンが合成できる事を示しました。さらに、複雑な生物活性天然物やペプチドを含む3-アシルインドリジンと光増感剤を連結させた光反応前駆体の合成を行い、赤色光の照射によって光反応前駆体から生物活性カルボン酸が効率的に放出される事を水溶液中で実証しました。
26. “Convergent Synthesis of Fluoroalkenes Using a Duar-Reactive Unit”
Motoyuki Isoda, Yuta Uetake, Tadashi Takimoto, Junpei Tsuda, Takamitsu Hosoya*, Takashi Niwa
J. Org. Chem. 2021, 86, 1622-1632, DOI:10.1021/acs.joc.0c02474
フルオロアルケンはその電子的・構造的特徴がアミドと高い相同性を持ち、生体内や医薬品中に多く含まれるアミド結合の代謝安定な等価体としての活用が期待されています。その合成法に関する研究は多数行われていますが、いずれも直線的な合成法という共通点があります。すなわち、適切な官能基を持つ部位を用意して、これを足がかりにフルオロアルケン部位を構築し、その後逆側の置換基を導入することで望みの分子を得るという方法です。狙いの構造が確定しているときには有用ですが、多様な構造を持つフルオロアルケンを網羅的に合成したい場合、工程数が増え非効率になるという欠点があります。
これに対し今回我々は、2つの置換基の順次導入により、収束的にフルオロアルケンを合成するため、合成素子を開発しました。この二炭素からなる合成素子は、求核的なホウ素部位と脱離基を有する求電子的な炭素を併せ持ち、適切な反応条件により順次置換基を導入することができます。今後、さらに多様な置換基を導入できる条件を見いだすことで、フルオロアルケンの自在合成が可能になり、代謝安定な医薬品候補化合物の創出が加速されるものと期待されます。

25. “Boracene-based alkylborate enabled Ni/Ir hybrid catalysis”
Yukiya Sato, Yusuke Miyamoto, Yuto Sumida*, Takamitsu Hosoya*, Hirohisa Ohmiya*
Org. Biomol. Chem. 2020, 18, 6598–6601, DOI:10.1039/D0OB01610A
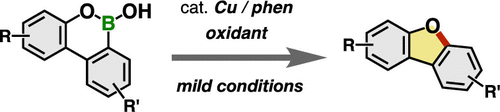
24. “Synthesis of Dibenzofurans by Cu-Catalyzed Deborylative Ring Contraction of Dibenzoxaborins”
Yuto Sumida*, Ryu Harada, Tomoe Sumida, Kohei Johmoto, Hidehiro Uekusa, Takamitsu Hosoya*
Org. Lett. 2020, 22, 6687–6691, DOI:10.1021/acs.orglett.0c02584
23. “Quantification of aromatase binding in the female human brain using [11C]cetrozole positron emission tomography”
My Jonasson,* Patrik Nordeman, Jonas Eriksson, Helena Wilking, Johan Wikstrom, Kayo Takahashi, Takashi Niwa, Takamitsu Hosoya, Yasuyoshi Watanabe, Gunnar Antoni, Inger Sundstrom Poromaa, Mark Lubberink, Erika Comasco*
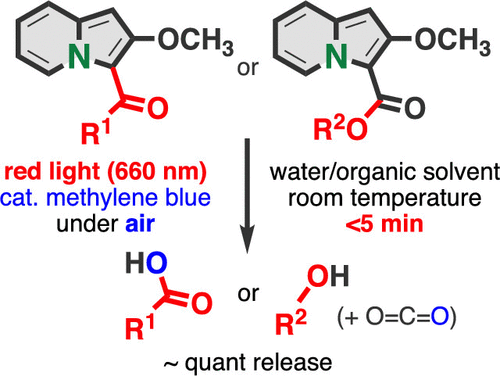
22. “Indolizines Enabling Rapid Uncaging of Alcohols and Carboxylic Acids by Red Light-Induced Photooxidation”
Kenji Watanabe*, Nodoka Terao, Isao Kii, Reiko Nakagawa, Takashi Niwa, Takamitsu Hosoya*
Org. Lett. 2020, 22, 5434–5438, DOI:10.1021/acs.orglett.0c01799
光分解性の保護基で生物活性化合物を保護・不活性化した後、光照射による脱保護で元の生物活性を取り戻す化合物はケージド化合物と呼ばれます。今回私たちは、触媒量の光増感剤の存在下、赤色LED光を短時間照射することによって、カルボン酸およびアルコールを放出するインドリジン環を母核とする新たなケージド化合物を開発しました。本手法は、酸素酸化を受けやすいオレフィン部位を持つ抗がん剤ベキサロテンの放出や、インドリジン部位を介してペプチドと連結された蛍光物質4-メチルウンベリフェノンの放出に適用することができました。今後、組織透過性の高い長波長光の照射によって生物活性を発現するケージド化合物の開発や高い薬効を示す抗体−薬物複合体の開発などに、本素子の活用が期待されます。
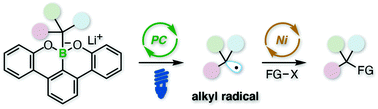
21. “Generation of Alkyl Radical through Direct Excitation of Boracene-Based Alkylborate”
Yukiya Sato, Kei Nakamura, Yuto Sumida*, Daisuke Hashizume, Takamitsu Hosoya*, Hirohisa Ohmiya*

* * *
20. “Practical Synthesis of [18F]Pitavastatin and Evaluation of Hepatobiliary Transport Activity in Rats by Positron Emission Tomography”
Takayoshi Nakaoka, Yuta Uetake, Ken-ichi Kaneko, Takashi Niwa, Hidenori Ochiai, Satsuki Irie, Yoshie Suezaki, Natsumi Otsuka, Emi Hayashinaka, Yasuhiro Wada, Yilong Cui, Kazuya Maeda, Hiroyuki Kusuhara, Yuichi Sugiyama, Takamitsu Hosoya, Yasuyoshi Watanabe*
Mol. Pharmaceutics 2020, in press, DOI:10.1021/acs.molpharmaceut.9b01284

19. “HaloTag-based conjugation of proteins to barcoding-oligonucleotides”
Junshi Yazaki, Yusuke Kawashima, Taisaku Ogawa, Atsuo Kobayashi, Mayu Okoshi, Takashi Watanabe, Suguru Yoshida, Isao Kii, Shohei Egami, Masayuki Amagai, Takamitsu Hosoya, Katsuyuki Shiroguchi, Osamu Ohara
Nucleic Acids Res. 2020, 48, e8. DOI:10.1093/nar/gkz1086
18. “Synthesis of (2,2-Diborylvinyl)arenes by Rhodium-Catalyzed Desulfanylative gem-Diborylation of 2-Arylvinyl Sulfides”
Yuta Uetake, Motoyuki Isoda, Takashi Niwa*, Takamitsu Hosoya*
Org. Lett. 2019, 21, 4933–4938. DOI:10.1021/acs.orglett.9b01253
アルケンの同一炭素上に二つのボリル基を有する(2,2-ジボリルビニル)アレーン類は、ホウ素部位の逐次的な変換ができることから、多置換アルケン合成のプラットフォームとしての利用が期待されています。今回我々は、アリールスルフィドのC-S結合切断を経るipso位ホウ素化の研究(Org. Lett. 2016, 18, 2758)の過程で、基質として2-アリールビニルスルフィドを用いたところ、gem-ジボリル化がロジウム触媒存在下に進行し、(2,2-ジボリルビニル)アレーン類が得られることを見いだしました。本反応は、アリールビニルスルフィドのE/Z-混合物を用いても、生成物を高収率で与えます。また、反応に必要な試薬がいずれも市販されており、汎用性の高いgem-ジボリルアルケンの合成法になると考えています。詳細な検討の結果、反応の進行に伴い副生成物として生じるピナコールボラン(HBpin)が、反応を加速させる効果を示すことも明らかにしました。

17. “Divergent synthesis of photoaffinity probe candidates by click reactions of azido-substituted aryltrifluoromethyldiazirines”
Kenji Watanabe, Junpei Tsuda, Hidenori Ochiai, Takashi Niwa, Takamitsu Hosoya*
Heterocycles. 2019, 99, 1366–1387. DOI:10.3987/COM-18-S(F)76
光親和性標識法は、光反応性官能基を有するプローブ分子を用いて、医薬品などの生物活性化合物の結合タンパク質および結合部位を特定する手法の一つです。今回、私たちは光親和性標識プローブ候補化合物の簡便合成を可能にする手法の開発を目指し、アジド基を有するアリールトリフルオロメチルジアジリンを2種類合成するとともに、これらが種々のクリック反応に効率的に利用できることを明らかにしました。また、これらのビルディングブロックを用いていくつかの生物活性化合物の光親和性標識プローブ候補化合物を合成しました。モデル基質とのクリック反応により得られた生成物は良好な光反応性を示したことから、今後、本手法を利用した光親和性標識プローブの開発が期待できます。

16. “Association between aromatase in human brains and personality traits”
Kayo Takahashi, Takamitsu Hosoya, Kayo Onoe, Tadayuki Takashima, Masaaki Tanaka, Akira Ishii, Yasuhito Nakatomi, Shusaku Tazawa, Kazuhiro Takahashi1, Hisashi Doi, YasuhiroWada Yasuyoshi Watanabe*
Sci. Rep 2018, 8, 16841. DOI:10.1038/s41598-018-35065-4
15. “Palladium(II)-mediated rapid 11C-cyanation of (hetero)arylborons”
Zhouen Zhang, Takashi Niwa, Yasuyoshi Watanabe, Takamitsu Hosoya
Org. Biomol. Chem 2018, 16, 7711–7716. DOI:10.1039/C8OB02049C
ベンゼン環上にシアノ基を有するシアノアレーン類は、医薬品や薬剤候補化合物などに広く見られる基本的な構造です。このため、シアノアレーン類を炭素11などのポジトロン放出核種で標識することができれば、多彩なPETプローブの合成を通じ、様々な生命現象の可視化が可能になります。標識においては、シアノ基が化学的に安定であることから、[11C]シアノ基の導入が有用です。今回我々は、入手容易な(ヘテロ)アリールボロン酸類を標識前駆体として用いる、新たな11C-シアノ化反応を開発しました。従来のシアノ化反応では銅錯体を用いる例が多かったのに対し、我々の11C-シアノ化反応ではパラジウム錯体の利用が非常に効果的でした。また、炭素11の半減期(およそ20.4分)を考えると、[11C]シアン化物として、[11C]メタンから最短で取得可能な[11C]シアン化アンモニウムを利用できる点も、本手法の重要な利点です。従来法よりも高い官能基許容性、放射化学収率(RCY)を示す本手法は、実際にいくつかのPETプローブの合成にも適用できました。今後、当チームは本手法を駆使して、新たなPETプローブの開発を進めていきます。

14. “Hydrosilyl Group-directed Iridium-catalyzed peri-Selective CH Borylation of Ring-fused (Hetero)Arenes ”
Yuto Sumida, Ryu Harada, Tomoe Sumida, Daisuke Hashizume, Takamitsu Hosoya
Chem. Lett. 2018, 47, 1251–1254. DOI:10.1246/cl.180594
オリゴアセン類の直接的かつ位置選択的な官能基化は、材料化学などにおいて有用な修飾アセン類を効率的に合成するための重要な手法です。なかでも、ナフタレンをはじめとするアセン類のペリ位官能基化は、反応点近傍の立体的な嵩高さゆえに比較的困難でしたが、近年、配向基を利用した直接的な官能基化がいくつか報告されています。今回我々は、ペリ位を選択的にホウ素化できれば、ホウ素官能基を起点として、さらなる多様な官能基化が可能となり、修飾アセン類の有用な合成法になると考えて検討を行ったところ、1位にジメチルヒドロシリル基を配向基)として有するナフタレンとビス(ピナコラート)ジボロンとの反応において、イリジウム触媒存在下、配位子として3,4,7,8-テトラメチル-1,10-フェナントロリンを用いることで、ペリ位選択的なホウ素化反応が効率よく進行することを見いだしました。本手法は、フェナントレンやインドールなどを含む他のπ共役系骨格にも適用可能であり、得られた化合物のいくつかはX線により構造を確認できました。

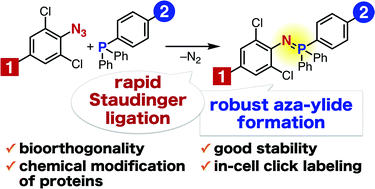
13. “Staudinger reaction using 2,6-dichlorophenyl azide derivatives for robust aza-ylide formation applicable to bioconjugation in living cells”
Tomohiro Meguro, Norikazu Terashima, Harumi Ito, Yuka Koike, Isao Kii, Suguru Yoshida* Takamitsu Hosoya*
Chem. Commun., 2018, Advanced Article.
12. “Quantification of receptor activation by oxytocin and vasopressin in endocytosis-coupled bioluminescence reduction assay using nanoKAZ”
Isao Kii∗, Shino Hirahara-Owada, Masataka Yamaguchi, Takashi Niwa, Yuka Koike, Rie Sonamoto, Harumi Ito, Kayo Takahashi, Chihiro Yokoyama, Takuya Hayashi, Takamitsu Hosoya, Yasuyoshi Watanabe
Anal. Biochem. 2018, 549, 174–183.

11. “Copper-Catalyzed Regioselective Monofluoroborylation of Polyfluoroalkenes en Route to Diverse Fluoroalkenes”
Hironobu Sakaguchiª, Yuta Uetakeª Masato Ohashi, Takashi Niwa*, Sensuke Ogoshi*, Takamitsu Hosoya*
(ª H.S. and Y.U. contributed equally.)
J. Am. Chem. Soc. 2017, 139, 12855–12862. DOI: 10.1021/jacs.7b08343
モノフルオロアルケンは、その電子的・構造的特徴がアミドと高い相同性を持つため、生体内や医薬品中に多く含まれるアミド結合の代謝安定な等価体としての活用が期待されています。今回我々は、gem-ジフルオロアルケンの脱フッ素ホウ素化反応が銅触媒存在下進行し、ホウ素を有するフルオロアルケンを得る反応を開発しました。本反応は幅広い官能基許容性を示し、グラムスケールでの合成も可能です。また、シリカゲルカラムクロマトグラフィーによる精製を必要としないため、大変汎用性の高い反応であると考えています。さらに本反応は条件を工夫することで、ポリフルオロアルケン類の脱フッ素ホウ素化反応にも適用できました。生成物である有機ホウ素化合物を活用することで、多様なモノフルオロアルケン類を簡便に合成することができます。実際に市販医薬品であるアトルバスタチン(リピトール®)のミミック医薬品の合成にも成功し、その生物活性が保持されることを実証しました。
本研究は、大阪大学大学院 工学研究科 応用化学専攻 生越研究室との共同研究による成果です。
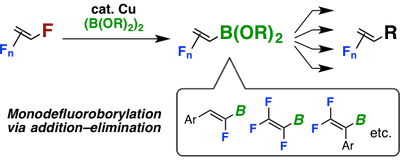
10. “A study on an unusual SN2 mechanism in the methylation of benzyne through nickel-complexation”
Makoto Hatakeyama,* Yuki Sakamoto, Koji Ogata, Yuto Sumida, Tomoe Sumida, Takamitsu Hosoya, Shinichiro Nakamura*
Phys. Chem. Phys. Chem. 2017, 19, 26926–26933. DOI: 10.1039/c7cp04739h
アライン-Ni錯体はヨードメタン、アルキン、二酸化炭素などの求電子剤と速やかに反応し、求核的な性質を有することが知られています。しかしながら、これまでの研究は錯体合成研究にとどまっており、その素反応ごとの反応機構については深く追求されていませんでした。今回我々は、理研イノベーション推進センター中村振一郎先生らのグループと共同研究を行うことにより、実験化学・計算化学の両面から、ベンザイン-Ni錯体とヨードメタンとの反応における反応機構の調査を行いました。
実験系としてArrheniusプロットによって活性化エネルギーを見積もるとともに、理論計算による遷移状態の探索を行うことで、妥当な反応機構を提示できました。またそれに伴って、アライン–Ni錯体は中心金属の極めて大きい逆供与のために二価Niの寄与が大きく、シクロメタラサイクルを形成すると推定され、それを起因としたC–Niの求核攻撃によるSN2機構で進行していることが示唆されました。

9. “Prenatal neurogenesis induction therapy normalizes brain structure and function in Down syndrome mice”
Akiko Nakano-Kobayashi, Tomonari Awaya, Isao Kii, Yuto Sumida, Yukiko Okuno, Suguru Yoshida, Tomoe Sumida, Haruhisa Inoue, Takamitsu Hosoya, Masatoshi Hagiwara*
Proc. Natl. Acad. Sci. USA. 2017, 114, 10268–10723.
京都大学 大学院医学研究科 萩原研との共同研究です。
8.“Nickel-Catalyzed Reductive Cross-Coupling of Aryl Triflates and Nonaflates with Alkyl Iodides” (invited paper)
Yuto Sumida*, Tomoe Sumida, Takamitsu Hosoya*,
Synthesis 2017, 49, 3582–3589. Special Topic DOI: 10.1055/s-0036-15884649 (Highlited in Synfacts)
遷移金属触媒によるクロスカップリング反応は、一般に求電子的な反応剤(有機ハロゲン化合物)と求核的な反応剤(有機金属化合物)を用いる化学反応で、今や現代有機合成にはなくてはならない強力な化学反応です。しかし、この有機金属化合物は、空気や水に不安定な場合があり、またこの有機金属化合物を調製する際には、しばしば有機ハロゲン化合物を経由します。そこで有機ハロゲン同士でクロスカップリング反応が行えればより効率的という考えから、近年、求電子的な反応剤同士を反応させる「還元的クロスカップリング反応」が盛んに開発されています。
今回我々は、この還元的クロスカップリング反応の基質として、アリールスルホナートを用いる手法を開発しました。スルホナートは擬ハロゲンとして扱える良い脱離基であり、アルコールやアルキルケトンなどから単工程で誘導できるため、汎用性の高い化合物群です。今回の論文では、Ni触媒存在下、このアリールスルホナートとアルキルヨージドによる還元的クロスカップリングが進行するとともに、本変換には不活性なことから、さらなる誘導化が可能なことを示すことができました。

7.“Facile Transformation of α,β-Unsaturated Carboxylic Acids to Alkenylboronic Esters via Rhodium-Catalyzed Decarbonylative Borylation of α,β-Unsaturated Thioesters”
Takashi Niwa*, Hidenori Ochiai, Motoyuki Isoda, Takamitsu Hosoya*,
Chem. Lett. 2017, 46, 1315–1318. DOI: 10.1246/cl.170549 (OPEN ACCESS)
[Selected as Editor's Choice]
アルケニルホウ素化合物は、医薬品や天然物の合成に広く用いられている有用な合成中間体です。ビニルホウ素化合物は一般に、アルキンのヒドロホウ素化や(擬)ハロアルケンの宮浦ホウ素化により合成されています。今回我々は、芳香族カルボン酸の形式的脱炭酸ホウ素化反応の反応条件(Publication 5)を参考に、α,β-不飽和カルボン酸から2段階で対応するアルケニルホウ素化合物を合成する手法を開発しました。すなわち、容易に入手可能なα,β-不飽和カルボン酸を対応するチオエステルへと変換し、これに対しロジウム触媒を用いて、50 °Cの加熱条件下ホウ素化試薬を作用させることで、脱一酸化炭素を伴いながら、目的とするホウ素化合物を合成することに成功しました。この反応は、以前報告した芳香族チオエステルの場合とは異なり、酢酸カリウムのような塩基を添加する必要がありません。また、本手法を適用することで、既存法では合成することが難しい、アシルホウ素化合物等価体となるアルケニルホウ素化合物を合成できることも示しました。

6.“Copper-Catalyzed ipso-Borylation of Fluoroarenes”
Takashi Niwa*, Hidenori Ochiai, Takamitsu Hosoya*,
ACS Catal. 2017, 7, 4535–4541. DOI: 10.1021/acscatal.7b01448 (OPEN ACCESS)
[Most Read Article in Jun.–Jul.., 2017, highest ranking: 2nd at Jul. 3, 2017.]
炭素−フッ素結合は最も強い共有結合の一つであり、その切断を経る変換は困難な課題の一つです。2015年、我々はニッケルと銅触媒を用いることで(publication 1)、またRuben Martinらはニッケル触媒を用いることで、フッ化アレーン類の炭素−フッ素結合の切断を経るホウ素化(脱フッ素ホウ素化反応)を独立に報告しました。これにより、フッ素を自在の官能基へと変換することが可能となりつつありますが、空気に不安定なニッケル触媒を用いるなど反応の実施が容易ではなく、有機合成化学への応用にはより簡便な手法の開発が望まれます。これに対し今回我々は、リン配位子をすでに有している取扱容易な銅錯体が、脱フッ素ホウ素化反応に有効であることを見いだしました。この銅錯体は大量合成が可能で、少なくとも1年間空気中で保管していてもその活性を損なわないほど安定です。この錯体を用いることで、デカグラム(10 g)スケールで脱フッ素ホウ素化が進行するほか、ポリフルオロアレーンを含む様々なフッ化アレーン類をホウ素化することができました。一方で、基質適用範囲やコントロール実験から、以前発表したニッケル・銅触媒系とは異なる反応性を示すことがわかりました。現在のところ、電子豊富な銅錯体からの一電子移動を起点とする反応機構を経て、脱フッ素ホウ素化反応が進行しているものと考えています。

5.“Rhodium-Catalyzed Decarbonylative Borylation of Aromatic Thioesters for Facile Diversification of Aromatic Carboxylic Acids”
Hidenori Ochiai, Yuta Uetake, Takashi Niwa*, Takamitsu Hosoya*,
Angew. Chem., Int. Ed. 2017, 56, 2482–2486. DOI: 10.1002/anie.201611974 (OPEN ACCESS)
プレスリリース (●Chem-Station スポットライトリサーチ ●科学新聞 ●Synfact)
芳香族カルボン酸は、多くの天然物・医薬品などに見られる重要な化学構造です。カルボン酸を化学選択的に反応性中間体へと変換することができれば、入手容易なカルボン酸を起点とした多彩な誘導体化が可能となります。一方、従来のカルボン酸の脱炭酸を伴う変換反応は、150 °C以上の高い温度を必要とする、あるいは適用可能な基質が限定的であるなどの問題点を有していました。また、カルボン酸を有機ホウ素化合物のような反応性中間体へ変換した例はこれまでに報告されていませんでした。
これに対し今回我々は、芳香族カルボン酸を2段階で有機ホウ素化合物へと変換する手法を開発しました。すなわち、カルボン酸をチオエステルに変換後、ロジウム触媒存在下、ホウ素化試薬を作用させることで、脱一酸化炭素を伴いながら、チオエステル部位をホウ素化することに成功しました。本変換反応は、80 °Cでの加熱という比較的温和な条件下で進行し、様々な官能基や複雑な化学構造を有するカルボン酸を、効率良く対応する有機ホウ素化合物に変換できました。本手法を天然物や医薬品などに適用することで、それらの多彩な誘導体化を迅速かつ簡便に実現できると期待されます。

4.“Stereoinversion of Stereocongested Carbocyclic Alcohols via Triflylation and Subsequent Treatment with Aqueous N,N-Dimethylformamide”
Hidenori Ochiai, Takashi Niwa, Takamitsu Hosoya*,
Org. Lett. 2016, 18, 5982–5985. DOI: 10.1021/acs.orglett.6b02675
炭素鎖上において水酸基の立体化学を反転させる反応は、有機合成化学において基本的かつ重要な変換の一つです。このような目的には光延反応や、トシルオキシ基やメシルオキシ基のカルボキシラートによる求核置換反応などが広く用いられてきました。しかしこれらの反応は、立体的に混雑した位置の水酸基では効率良く進行しないという問題を有していました。今回我々は、脂環式アルコールの立体的に混雑した位置の水酸基の効率な立体反転を目指して、水酸基のトリフリル化と、続くN,N-ジメチルホルムアミドの求核置換反応によるホルミルオキシ化を経由した、水酸基の立体反転反応を開発しました。本法を用いて各種官能基を有する糖誘導体を含む、多置換の脂環式アルコールの水酸基を立体反転できることがわかりました。本手法は光延反応の相補的な手法になると期待されます。

3.“Preparation of Aryne−Nickel Complexes from ortho-Borylaryl Triflates”
Yuto Sumida, Tomoe Sumida, Daisuke Hashizume, Takamitsu Hosoya*
Org. Lett. 2016, 18, 5600–5603. DOI: 10.1021/acs.orglett.6b02831
アラインは、通常は単離できない不安定中間体であり、系中で発生させながら変換反応に利用されてきました。一方、アライン–金属錯体は、アラインが金属に配位した化学種であり、配位子と金属の組み合わせによっては単離可能です。なかでもアライン–Ni錯体は、求電子剤と速やかに反応することが報告されており、この結果はアラインとは異なり、求核的な性質であることを示しています。しかし、アライン–Ni錯体については、その前駆体合成が煩雑であるため、アラインと比べると合成化学への応用例が極めて少ないことが知られていました。今回我々は、以前に独自に開発した含ホウ素アライン前駆体を利用したアライン–Ni錯体の調製法を確立しました。これにより、合成容易な共通前駆体から反応条件を変えるだけで、アラインの発生とアライン–Ni錯体の調製が行えるようになりました。さらに、このアライン–Ni錯体を用いて、形式的なアラインの二重官能基化を行うことにも成功しました。

2.“Rhodium-Catalyzed ispo-Borylation of Alkylthioarenes via C–S Bond Cleavage”
Yuta Uetake, Takashi Niwa, Takamitsu Hosoya*
Org. Lett. 2016, 18, 2758–2761. DOI: 10.1021/acs.orglett.6b01250.
炭素–硫黄結合の切断を経たアリールスルフィド類の官能基変換反応は、これまで炭素–炭素結合や炭素–窒素結合の形成反応、もしくは還元反応に限られていました。今回我々は、電子豊富なロジウム触媒を用いることで、炭素–硫黄結合の切断を経るホウ素化反応が進行することを見いだしました。これにより、ホウ素の多彩な反応性を活用することで、様々な化学結合への変換が可能になります。さらに、本反応とこれまでに知られているC–Hホウ素化反応とを組み合わせることで、単純なアリールスルフィド類から多様な置換様式をもつ芳香族化合物を位置選択的に合成できることを示しました。本法は、スルファニル基をC–Hホウ素化反応の配向基として利用した後、それ自体もまた、多彩な分子変換が可能なホウ酸エステルへと変換できる便利な手法です。

1.“Ni/Cu-Catalyzed Defluoroborylation of Fluoroarenes for Diverse C–F Bond Functionalization”
Takashi Niwa,* Hidenori Ochiai, Yasuyoshi Watanabe, Takamitsu Hosoya*
J. Am. Chem. Soc. 2015, 137, 14313–14318. DOI: 10.1021/jacs.5b10119
[Most Read Article in Nov.–Dec.., 2015, highest ranking: 6th at Dec. 2, 2015.]
プレスリリース (●マイナビニュース●ダイキン ファインケミカル部webマガジン●Chem-Station スポットライトリサーチ●たゆたえども沈まず-有機化学あれこれ-(化学系ブログ)●科学新聞 ●RIKEN Research ●薬事日報 (2016年3月11日朝刊 に掲載))
炭素−フッ素結合は非常に安定な化学結合です。特にフッ素原子を一つしか持たない単純なフッ化アレーン類の反応性は極めて低く、その化学変換の例は限られます。今回我々は、ニッケルと銅の触媒を併用することで、炭素–フッ素結合の切断を経るホウ素化反応(脱フッ素ホウ素化)が進行することを見いだしました。生成物である有機ホウ素化合物は、温和な条件下で様々な化学変換が可能です。これを用いて、医薬品であるフルバスタチン誘導体をモデルに、炭素–フッ素結合の様々な官能基化が可能であることを示しました。本法を用いると、含フッ素医薬品の18F-標識PETプローブ化も迅速に行うことができます。

Review
4.“Molecular Renovation Strategy for Expeditious Synthesis of Molecular Probes”
Takashi Niwa, Takamitsu Hosoya, Bull. Chem. Soc. Jpn. 2020, in press.


1.“2種のアジド分子を効率的に連結する手法の開発”
吉田 優1, 喜井 勲2, 細谷孝充1,2* (1. 医科歯科大生材研, 2. 理研CLST)
各人の論文リストはMemberページをご覧ください